- HUMAN Diagnostics Worldwide | France
- Professionnels de laboratoire
- Tendances et thèmes d'actualité
Petites piqûres, menace mondiale : le paludisme
La propagation des maladies à transmission vectorielle est une menace pour la santé publique. Il n’existe pas encore de solution de diagnostic adéquate pour la gestion de la maladie et son élimination. Une nouvelle méthode pourrait changer la donne dans la lutte contre le paludisme.
Les maladies à transmission vectorielle
Les maladies à transmission vectorielle suscitent un regain d'intérêt avec la récente propagation du virus Zika, incriminé dans des microcéphalies congénitales.
Souvent fatales ou invalidantes, les maladies à transmission vectorielle représentent plus de 17 % des cas de maladies infectieuses dans le monde. Elles affectent plus d’un milliard de personnes par an, dont plus d’un million en meurent1. Bien qu’elles sévissent surtout dans les régions tropicales et subtropicales, elles peuvent également apparaître dans d’autres régions à cause de l’intensification des voyages, de l’urbanisation et du changement climatique. Pour les contrer, on manque encore de tests de diagnostic rapides, précis et peu coûteux, et pas seulement dans les environnements à ressources limitées. Elles font partie, de ce fait, des maladies infectieuses les plus difficiles à prévenir et à contrôler. La prévention passe en priorité par la sensibilisation des populations à la nécessité d’un diagnostic précis, d’un assainissement systématique et de la lutte contre les vecteurs. HUMAN s’engage pour la lutte contre les maladies infectieuses, notamment dans les situations où les ressources sont limitées. Nous allons réunir, sous le titre « Petites piqûres, menace mondiale », des articles consacrés au diagnostic de différentes maladies à transmission vectorielle.
Exemples de maladies à transmission vectorielle avec leur vecteur et leur agent pathogène
| Maladie | Vecteur | Agent pathogène |
|---|---|---|
| Paludisme | Moustique femelle (genre Anopheles) | Protozoaire (Plasmodium) |
| Dengue | Moustique femelle (Aedes aegypti) | Virus de la dengue |
| Zika | Moustique (espèce du genre Aedes) | Virus Zika |
| Maladie de Chagas | Punaise (Triatominae) | Trypanosoma cruzi |
| Maladie du sommeil | Mouche tsétsé | Trypanosoma brucei |
| Leishmaniose | Phlébotomes femelles | Protozoaire (Leishmania) |
| Schistosomiase | Escargot d’eau douce | Ver plat (genre Schistosoma) |
| Fièvre du Nil occidental | Moustique | Virus du Nil occidental (VNO) |
| Encéphalite japonaise | Moustique (espèce du genre Culex) | Virus de l’encéphalite japonaise |
| Fièvre jaune | Moustique (espèces des genres Aedes et Haemagogus) | Virus de la fièvre jaune |
Le paludisme : le diagnostic à l’avant-plan de la lutte et de l’élimination de la maladie
Un diagnostic rapide et précis des infections récentes et/ou asymptomatiques est indispensable pour le traitement, la lutte et l’élimination efficaces des maladies à transmission vectorielle. Il peut faire appel aux tests de laboratoire les plus perfectionnés, comme les techniques d’amplification des acides nucléiques (NAAT), les tests de diagnostic rapides (TDR) ou les tests ELISA, mais aussi aux classiques examens au microscope de frottis sanguins.
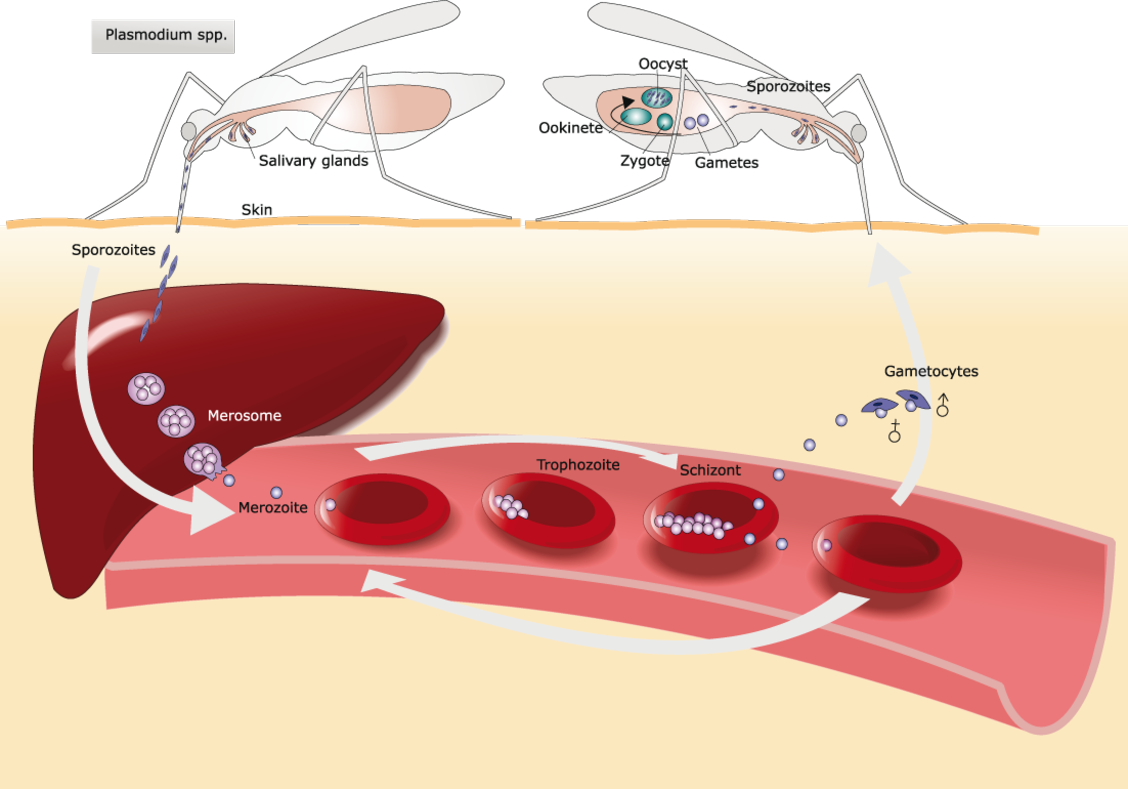
Quatre des cinq espèces du genre Plasmodium (P. falciparum, P. vivax, P. ovale et P. malariae) sont des agents du paludisme humain. Chez les humains, ces protozoaires parasites se multiplient de façon exponentielle dans le foie puis, après plusieurs stades de développement, infestent les globules rouges.
P. falciparum et P. vivax sont les espèces les plus importantes en raison de leur large prévalence et le paludisme causé par P. falciparum est la forme la plus mortelle2. Plasmodium falciparum peut échapper au système immunitaire pendant la majeure partie de son cycle vital. Il se multiplie rapidement dans le sang et l’infection peut ainsi se développer très vite jusqu’à un stade très grave de la maladie. P. falciparum altère la surface des érythrocytes infectés et les rend « collants ». Les globules rouges adhèrent ainsi aux cellules endothéliales qui tapissent les vaisseaux sanguins, créant un risque majeur d’occlusion vasculaire, notamment dans les capillaires du cerveau (paludisme cérébral) et les reins, d’hypoxie et de graves dégâts au niveau des organes.
Faits et chiffres
- Risque : on estime que 3,4 milliards de personnes dans le monde sont exposées au risque de paludisme (Fig. 1).
- Morbidité et mortalité : 207 millions de cas cliniques et 627 000 décès en 2012
- Mortalité en 2010 : 91 % des décès en Afrique
Population à risque
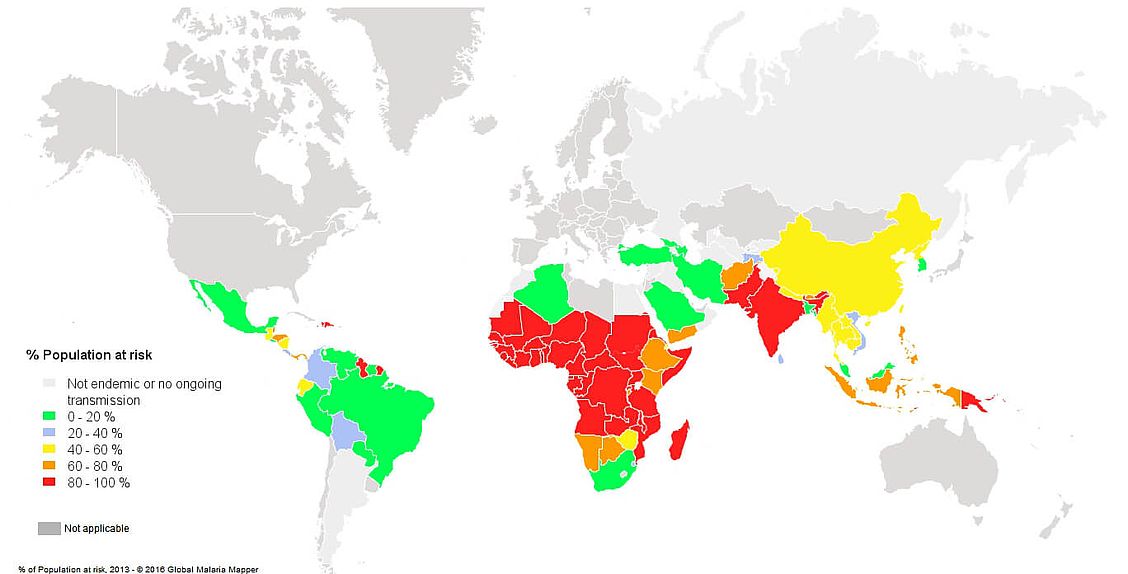
Fig. 1. Population à risque de contracter le paludisme, selon les données de 20133
Produits connexes
Les défis du diagnostic du paludisme
Un diagnostic précis et rapide est indispensable au traitement et à l’éradication efficaces du paludisme. Un traitement non sélectif des cas suspects ouvre la voie au développement de résistances aux médicaments antipaludiques (FIND). L’OMS recommande actuellement un diagnostic rapide de tous les cas suspects de paludisme par microscopie ou par un test de diagnostic rapide (TDR).
Le diagnostic au microscope a l’inconvénient de nécessiter des biologistes bien formés et compétents. Il n’est donc pas pratique sur le terrain. Les tests de diagnostic rapide (TDR) conviennent idéalement sur le terrain mais quelques-uns seulement détectent directement les infections à P. vivax et aucun ne peut déceler les réservoirs dormants de ce parasite dans le foie (voir plus loin).
En outre, il n’est pas possible de diagnostiquer les infections subcliniques dans des sites éloignés.
Aussi sensible que la PCR et aussi robuste que les TDR
Les techniques d’amplification de l’acide nucléique (NAAT) telles que la PCR en temps réel permettent d'identifier les infections subcliniques et submicrosopiques. La PCR en temps réel est toutefois inaccessible dans les structures à ressources limitées et les sites éloignés car elle nécessite une infrastructure et des réactifs coûteux et une expertise technique. Les techniques de diagnostic moléculaire isotherme telles que l’amplification isotherme induite par boucle (LAMP), l’amplification de séquences d’acides nucléiques (NASBA), l’amplification thermophile hélicase-dépendante (tHDA) et l’amplification recombinase-polymérase (RPA) allient une grande sensibilité analytique à des spécifications techniques qui facilitent leur mise en œuvre dans des zones rurales ou éloignées. Selon la FIND, la technique LAMP est en pointe car elle offre les avantages d’un test sensible et spécifique avec des spécifications d’installation minimes et des cadences élevées4,5. Elle ouvre la voie à des campagnes et des projets efficaces d’éradication du paludisme. La détection spécifique du paludisme à P. vivax par LAMP sera très prochainement possible.
En résumé, la détection fiable des infections subcliniques est indispensable pour lutter contre le paludisme et l’éliminer. La bonne nouvelle, c’est qu'il existe des technologies qui rendent cette détection possible.
Considérations importantes pour le diagnostic du paludisme
- Rechutes du paludisme
P. vivax a un cycle de vie unique en son genre : après avoir envahi les cellules du foie humain, il peut soit poursuivre son cycle d’infestation, soit entrer en dormance sous une forme appelée « hypnozoïtes ». Après leur réactivation, des mois voire des années plus tard, les hypnozoïtes peuvent causer des symptômes alors que la personne infectée n’a pas été piquée récemment par un moustique2. Les hypnozoïtes sont difficiles à détecter car le parasite s’enveloppe dans la membrane d’une cellule hépatique infestée et se protège ainsi des attaques du système immunitaire6. Il n’existe pas actuellement de biomarqueurs ni de méthodes de diagnostic permettant de déceler les hypnozoïtes dormants. Le seul moyen de reconnaître ce stade de dormance hépatique est la constatation d’une rechute suite à l’activation des hypnozoïtes.
- Résistance à P. vivax de certaines populations
P. vivax est plus largement répandu que P. falciparum parce qu’il peut utiliser comme vecteur le moustique anophèle, qui survit à des températures plus basses, et peut ainsi atteindre des altitudes plus élevées et des climats plus frais. Il peut en outre former des hypnozoïtes dormants. P. vivax utilise l’antigène Duffy présent sur les érythrocytes comme récepteur pour s’attacher à ces cellules et les envahir. Les sujets qui ne possèdent pas l’antigène Duffy, ce qui est le cas de nombreux groupes de population en Afrique, sont donc résistants à l’infection7. Toutefois, on a rapporté la présence de P. vivax chez des sujets « Duffy-négatifs », ce qui suggère que le parasite utilise aussi d’autres récepteurs pour envahir les érythrocytes8. Ces observations peuvent avoir des implications énormes sur la distribution de P. vivax et doivent être prises en considération dans le diagnostic du paludisme.
- Résistance aux médicaments antipaludiques
L’apparition de P. falciparum résistants aux antipaludéens dans plusieurs pays d’Asie et d’Afrique est très préoccupante. Elle compromet les succès remportés dans la réduction de la morbidité et de la mortalité liées au paludisme9. Un test de diagnostic recherchant une possible résistance devrait être envisagé avant la mise en place d’un traitement antipaludique.
Références
- World Health Day 2014 campaign. (accessed on 01.08.2014): http://www.who.int/campaigns/world-health-day/2014/key-messages/en/.
- World Health Organization Web site, WHO Global Malaria Programme: World Malaria Report: 2013.
- Global Malaria Mapper. (accessed on 18.10.2016)
- Vallejo, A.F., et al., Evaluation of the loop mediated isothermal DNA amplification (LAMP) kit for malaria diagnosis in P. vivax endemic settings of Colombia. PLoS Negl Trop Dis, 2015. 9.
- Hopkins, H., et al., Highly sensitive detection of malaria parasitemia in a malaria-endemic setting: performance of a new loop-mediated isothermal amplification kit in a remote clinic in Uganda. J Infect Dis, 2013. 208.
- Vaughan, A.M., A.S.I. Aly, and S.H.I. Kappe, Malaria Parasite Pre-Erythrocytic Stage Infection: Gliding and Hiding. Cell Host & Microbe. 4(3): p. 209-218.
- Zimmerman, P.A., et al., Red blood cell polymorphism and susceptibility to Plasmodium vivax. Adv Parasitol, 2013. 81: p. 27-76.
- Mendes, C., et al., Duffy negative antigen is no longer a barrier to Plasmodium vivax--molecular evidences from the African West Coast (Angola and Equatorial Guinea). PLoS Negl Trop Dis, 2011. 5(6): p. e1192.
- Ashley, E.A., et al., Spread of Artemisinin Resistance in Plasmodium falciparum Malaria. N Engl J Med, 2014. 371(5): p. 411-423.
- Britton, S., Q. Cheng, and J.S. McCarthy, Novel molecular diagnostic tools for malaria elimination: a review of options from the point of view of high-throughput and applicability in resource limited settings. Malar J, 2016. 15: p. 88.