- HUMAN Diagnostics Worldwide | France
- Professionnels de laboratoire
- Tendances et thèmes d'actualité
Efficacité diagnostique accrue grâce à l’association de la différenciation en 5 populations et de la protéine C réactive.
Résumé / Note de synthèse
Un délai d'exécution rapide des tests diagnostiques est très important pour les professionnels de la santé ; il leur permet de décider rapidement d’une stratégie thérapeutique adaptée à leurs patients.
L’association des paramètres de la protéine C réactive (CRP) et de la numération formule sanguine (NFS), généralement inclus dans l'examen précoce des patients, peut réduire le délai d'exécution et est bénéfique pour les patients dans les cabinets médicaux, les unités de soins intensifs et les services d'urgence. Cette combinaison de paramètres peut être particulièrement utile pour différencier les infections bactériennes des infections virales. Elle joue également un rôle dans de nombreux autres domaines de diagnostic tels que la recherche de fièvre, la détection d’inflammations aiguës et chroniques, de maladies auto-immunes, d’infections au COVID-19, dans le contrôle des infections post-opératoires et bien d'autres.
Cet article se concentre sur les avantages de l’association de la CRP avec la NFS dans un même système de diagnostic et sur la façon dont cette association peut améliorer le flux de travail et l'efficacité des diagnostics.
Numération formule sanguine et protéine C réactive
La numération formule sanguine (NFS) est un examen sanguin complet essentiel pour la détermination du type, du nombre, de la taille et d'autres caractéristiques des cellules sanguines d'un patient. La NFS mesure la quantité de globules rouges (GR), de plaquettes (Pt) et de globules blancs (GB), y compris la numération différentielle des globules blancs. Chacun de ces types de cellules sanguines remplit des fonctions importantes, de sorte que la détermination de leurs niveaux peut fournir des informations importantes sur l'état de santé général du patient et peut aider à diagnostiquer un certain nombre d'affections.
Il s'agit d'un outil médical important car il permet d'analyser, à partir d'un seul échantillon, l'ensemble des cellules présentes dans le sang, ainsi que certaines de leurs caractéristiques physiques1. Un dosage de la protéine C réactive est souvent demandé en même temps qu'une numération formule sanguine. La protéine C réactive (CRP) est une protéine de phase aiguë hautement sensible qui est libérée dans la circulation sanguine dans les heures qui suivent une blessure, une infection ou d'autres causes d'inflammation.2,3
Une augmentation du taux de CRP peut précéder les symptômes cliniques d'une maladie particulière, comme la douleur ou la fièvre, permettant alors un diagnostic précoce. La CRP est particulièrement utile pour le diagnostic et l'évaluation des infections, la recherche de fièvre, la différenciation entre les infections bactériennes et virales et la détection de maladies inflammatoires.
La CRP et la NFS sont d’importants outils de diagnostic pour un large éventail de maladies et d'affections.
Les infections bactériennes et virales provoquent des symptômes similaires tels qu’une faiblesse, de la fièvre ou encore des douleurs musculaires. Actuellement, les antibiotiques sont souvent prescrits librement sans confirmation clinique de la présence de bactéries. Malheureusement, il est souvent difficile de distinguer les infections bactériennes des infections virales sur la base de signes et de symptômes non spécifiques, notamment dans le cas des infections respiratoires.4,5,6
Une différenciation précoce entre les deux types d'infection est essentielle pour un diagnostic et un traitement appropriés. Alors que les infections bactériennes sont généralement traitées par antibiotiques, le traitement antibiotique est inefficace et contre-productif dans le cas des infections virales. Les taux de prescription inappropriés et la surconsommation d'antibiotiques entraînent une résistance aux antimicrobiens qui constitue l'une des plus grandes menaces pour la santé mondiale.7 Les antibiotiques ne doivent être prescrits et administrés qu'en cas de besoin, conformément aux lignes directrices actuelles.8
La combinaison de la numération formule sanguine et de la CRP est un moyen efficace d'améliorer le diagnostic et peut contribuer à réduire le nombre de prescriptions inutiles d'antibiotiques.9 Le tableau ci-dessous présente les plages de référence de la CRP pour différentes affections et causes possibles :
|
Plage de la CRP |
Activité de la maladie |
Causes |
|
< 5 mg/L |
s/o |
s/o |
|
5 – 10 mg/L |
Inflammation très légère |
Obésité, diabète sucré de type 2, maladies cardiovasculaires athérosclérotiques, tabagisme, grossesse, etc. |
|
10 – 40 mg/L |
Inflammation légère |
Abcès local, traumatisme chirurgical mineur, traumatisme accidentel, infarctus du myocarde, thrombose veineuse profonde, maladie rhumatismale inactive, maladie de Crohn, tumeur maligne métastatique, infections virales isolées, etc. |
|
40 - 100 mg/L |
Inflammation modérée |
Processus inflammatoires graves tels que la bronchite, la cystite purulente, la suppuration dentaire, l'infection des voies urinaires et les infections génitales. Les infections nécessitent une intervention médicale, par exemple un traitement avec des antibiotiques. |
|
>100 mg/L |
Inflammation importante |
Infections aiguës généralisées causées par des bactéries et des champignons (septicémie) ainsi que des lésions tissulaires graves après un polytraumatisme ou une intervention chirurgicale majeure. |
(Adapté de : Thomas, L. C-reaktives Protein (CRP) In: Prof. Dr. Lothar Thomas, Kirschbaumweg 8, 60489 Frankfurt (ed.) Labor und Diagnose 2020. Chapter 19.4. Accessed September 19, 2023. https://www.labor-und-diagnose-2020.de)
Bien que des études récentes aient mis en évidence de nouveaux biomarqueurs d'infection bactérienne, l’analyse de la CRP et la NFS restent des examens rentables, avec une normalisation de laboratoire bien établie, un matériel de contrôle qualité interne (CQI) robuste et des programmes d'assurance qualité externe (EQA) largement disponibles. La littérature consultée suggère que le dosage de la CRP peut permettre de favoriser une utilisation rationnelle des antibiotiques chez les patients fébriles, en particulier dans les milieux à ressources limitées.10
L’association de la numération formule sanguine et de la CRP joue un rôle important, entre autres, dans la détection des fièvres telles que le paludisme, la dengue, etc. Bien que la fièvre puisse être causée par une infection banale, elle peut aussi être le symptôme d'une infection qui évolue rapidement et qui est mortelle. Un délai de diagnostic court suivi d’un traitement initié aussitôt que possible peut donc être nécessaire pour sauver la vie d'un patient11. Un examen détaillé de l'évolution clinique couplé à un examen physique et aux données de laboratoire sont essentiels pour déterminer la cause probable de la fièvre.
Les infections par la dengue et le paludisme par exemple, qui coexistent souvent dans les zones endémiques, présentent des symptômes similaires et génèrent des anomalies assez semblables lors de l’examen de la numération formule sanguine. La combinaison du taux de CRP et de la numération plaquettaire (Pt) peut être utile pour distinguer la dengue du paludisme, une Pt basse étant indicative de la dengue, tandis qu'une Pt basse associée à un taux de CRP élevé révèle plutôt un paludisme12. De nombreuses infections parasitaires sont associées à une éosinophilie. Cependant dans le cas du paludisme, une infection protozoaire, les éosinophiles (EOS) se situent dans la gamme de valeurs normale13. La CRP n'est donc pas un biomarqueur spécifique du paludisme et sa sensibilité aux infections virales est faible. Il s'agit tout de même d'un paramètre important pour comprendre l'étiologie de l'infection et pour distinguer le paludisme et la dengue d'autres maladies présentant des anomalies hématologiques similaires14. Néanmoins, la dengue et d'autres infections non virales peuvent coexister dans un même échantillon, de sorte que la CRP seule ne doit pas être un critère exclusif de différenciation des deux maladies.
|
Maladie |
Type d'infection |
GB |
Pt |
EOS |
CRP |
|
Dengue |
Virus |
Très faible |
Très faible |
Normal/faible |
Normal |
|
Paludisme |
Protozoaire |
Normal/faible |
Faible |
Normal/faible |
Élevé |
Tableau 1 : Résultats de l'examen des patients atteints de paludisme et de dengue
Pendant la pandémie de COVID-19, la CRP a joué un rôle important dans le diagnostic et le suivi de la maladie. Au début de la pandémie, alors que ni la PCR ni les tests rapides n'étaient disponibles, il était nécessaire de concevoir un moyen pratique et efficace de dépister l'infection à COVID-19 dans de larges populations. Les premiers rapports en provenance de Chine recommandaient que la numération des globules blancs et la protéine C réactive soient incluses dans les tests de laboratoire pour la surveillance précoce de l'infection.15 Outre la saturation pulsée en oxygène (SpO2), un nombre de lymphocytes inférieur à 1100/μl et un taux élevé de CRP ont été utilisés pour le triage précoce des patients. Ces paramètres, combinés aux signes cliniques, ont aidé à différencier les patients nécessitant une hospitalisation de ceux qui pouvaient rester chez eux en s'isolant. Par conséquent, les appareils d'hématologie qui associent analyse de la CRP et de la NFS à partir du même échantillon sont utiles pour un diagnostic rapide et ont été préférés par de nombreuses cliniques.
La CRP est l'un des marqueurs inflammatoires permettant d'évaluer efficacement la gravité de la maladie. Des taux élevés de CRP sont associés au développement d'une maladie grave et sont liés aux lésions pulmonaires aux premiers stades du COVID-19.16,17 Il a été démontré qu'un niveau élevé de CRP est associé à un mauvais pronostic chez les patients positifs au COVID-19 et est donc utilisée comme marqueur pour surveiller la progression de la maladie.18
Outre les applications décrites ci-dessus, l'analyse de la CRP couplée à une numération formule sanguine joue un rôle important dans de nombreux autres diagnostiques. Par exemple, elle est utilisée pour le diagnostic de l'appendicite, la CRP ayant la plus grande précision diagnostique dans les cas compliqués. Le diagnostic de l'appendicite ne doit pas être réalisé uniquement sur la base de l'examen clinique, et des marqueurs d'inflammation plus spécifiques et systémiques sont nécessaires. L'association de la CRP et des GB peut permettre de parfaire le diagnostic. L'utilisation combinée des valeurs seuils pour les GB (≥ 13 100/μl) et la CRP (≥ 1,17 mg/l) donne une sensibilité plus élevée pour le diagnostic d’une appendicite compliquée.19
Comme un nombre croissant d'études expérimentales suggèrent un lien entre l'inflammation et le cancer, plusieurs études d'observation ont été menées pour étudier l'association entre les marqueurs inflammatoires, tels que la CRP et les globules blancs, et un risque accru de cancer. Une étude suédoise portant sur plus de 100 000 patients apporte des preuves supplémentaires d'une association entre des niveaux élevés de CRP et de leucocytes et le risque global de cancer20. En outre, la CRP et la numération leucocytaire peuvent être des indicateurs pronostiques doubles de tumeurs solides et d’hémopathies malignes.21
Les tests de diagnostic des maladies auto-immunes sont un autre domaine où la NFS et les marqueurs inflammatoires tels que la CRP sont nécessaires. Comme les maladies auto-immunes peuvent toucher plusieurs organes et provoquer des signes et des symptômes très variables dont la gravité peut évoluer avec le temps, il peut être difficile de les reconnaître et de les diagnostiquer. Les analyses de sang qui indiquent la présence d'une inflammation sont généralement utilisées pour diagnostiquer une maladie auto-immune. Une numération formule sanguine (NFS) peut révéler des résultats caractéristiques de ces maladies tels qu'une anémie normocytaire et normochrome, qui indique la chronicité ou la gravité de la maladie, et une augmentation ou une diminution du nombre de plaquettes et/ou de globules blancs. En combinaison avec la CRP, il est possible d'obtenir des informations plus détaillées sur une inflammation en cours.22
Cette synthèse démontre que l’association des marqueurs CRP et de la NFS est nécessaire et bénéfique pour le diagnostic de nombreuses maladies. Cependant, le processus traditionnel d'analyse de ces marqueurs sur différents dispositifs de diagnostic n'est pas simple et une prise de décision thérapeutique demande généralement du temps.
HumaCount 5DCRP – la solution 2-en-1 idéale pour la différenciation en 5 populations et la CRP à partir d'une seule goutte de sang
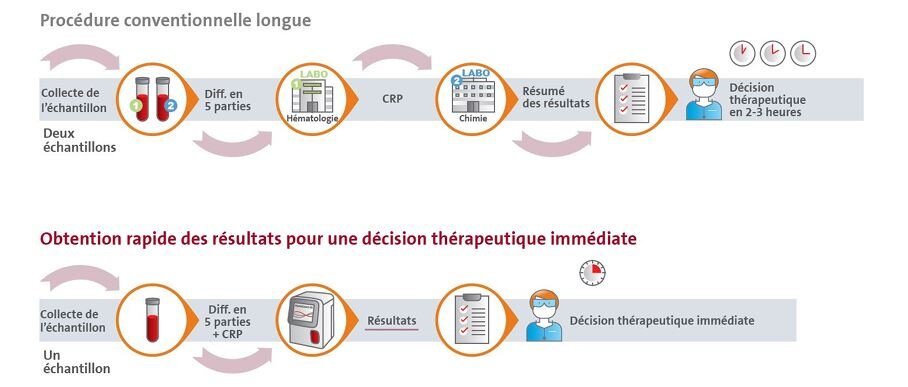
Le processus conventionnel d'analyse de la CRP et de la NFS prend beaucoup de temps. Il requiert deux prélèvements sanguins sur le patient, un prélèvement de sang total pour la NFS et un prélèvement de sérum ou de plasma pour la CRP.
La détection de la CRP à l'aide d'un analyseur de biochimie nécessite également plusieurs étapes. Tout d'abord, les échantillons doivent être prélevés en vue d'une analyse en série, puis centrifugés, placés sur l'analyseur, et enfin les résultats des tests d'hématologie et de CRP doivent être combinés. Plusieurs heures peuvent s'écouler avant que le médecin ne prenne une décision quant au traitement.
Au contraire, le HumaCount 5DCRP offre un flux de travail optimisé pour combiner l'analyse de la CRP et la NFS à partir d'un seul échantillon de sang. Le système fournit des résultats rapides en 1,5 minutes seulement, ce qui permet de poser rapidement un diagnostic et de planifier un traitement. Cela favorise un accroissement de l'efficacité et une réduction des coûts tout en éliminant la nécessité d'effectuer des tests supplémentaires. L’appareil est particulièrement utile pour différencier les infections bactériennes des infections virales et peut contribuer à lutter contre le problème mondial de résistance aux antimicrobiens en évitant les prescriptions inutiles d'antibiotiques.

Flux de travail optimisé avec le HumaCount 5DCRP
Amélioration de l'efficacité et de la qualité des examens cliniques
La combinaison des tests de la NFS et de la CRP fournit des informations d'une grande valeur clinique, permettant des décisions médicales plus rapides et plus précises afin de réduire la durée d'hospitalisation et les coûts pour le patient. Les patients bénéficient d'un prélèvement sanguin simple et indolore grâce à la ponction veineuse capillaire.
La technologie OptimalCount, qui ne nécessite que 20 μl de sang capillaire, garantit des taux de dilution corrects grâce à la distribution automatique de diluant et effectue une numération d’environ 3000 cellules. Cette combinaison de facteurs permet une grande exactitude, qui n'est généralement obtenue qu'avec des échantillons veineux.
Les cliniques pédiatriques et les maternités peuvent grandement bénéficier de cette méthode de prélèvement direct de sang capillaire. Elle peut également être utile pour tout patient dont les veines sont fragiles, par exemple les personnes âgées, les patients sous chimiothérapie ou ceux qui ont peur des aiguilles. Grâce aux diagnostics améliorés, les médecins sont capables de distinguer les infections virales des infections bactériennes. Souvent, les patients souffrant d'une infection respiratoire s'attendent à ce que le médecin leur prescrive des antibiotiques, même si la maladie peut être causée par une infection virale pour laquelle les antibiotiques sont inutiles. Le HumaCount 5DCRP, qui combine l’analyse de la CRP et la NFS, fournit un diagnostic clair et les résultats peuvent également être utilisés pour expliquer au patient pourquoi les antibiotiques ne sont peut-être pas indiqués. Grâce à sa petite taille et à l'absence d'ordinateur externe, l'unité peut être installée dans un cabinet médical où l'espace est limité.
Le HumaCount 5DCRP peut également être utile dans les services hospitaliers pour surveiller rapidement l'état de santé du patient sans avoir à envoyer un échantillon au laboratoire central et à attendre les résultats. Il en va de même dans les situations où il est extrêmement important de prendre des décisions rapides, comme dans les salles d'urgence ou les unités de soins intensifs.
Conclusion et perspectives
En résumé, le HumaCount 5DCRP, avec sa combinaison unique de la numération formule sanguine et de la CRP, est un complément utile à une variété d'applications diagnostiques et de nombreux types d'utilisateurs peuvent bénéficier du système. C'est l’outil idéal pour un diagnostic rapide, mais aussi pour la surveillance des maladies graves et chroniques, le suivi des infections et du traitement des patients ainsi que pour garantir l'efficacité des antibiotiques.
Bibliographie
- www.testing.com/tests/complete-blood-count-cbc/ Accessed September 19, 2023
- https://www.testing.com/tests/c-reactive-protein-crp/ Accessed September 19, 2023
- Thomas, L. C-reaktives Protein (CRP) In: Prof. Dr. Lothar Thomas, Kirschbaumweg 8, 60489 Frankfurt (ed.) Labor und Diagnose 2020. Chapter 19.4. Accessed September 19, 2023. https://www.labor-und-diagnose-2020.de
- De Sutter A, Lemiengre M, Van Maele G, van Driel M, De Meyere M, Christiaens T, De Maeseneer J. Predicting prognosis and effect of antibiotic treatment in rhinosinusitis. Ann Fam Med. 2006 Nov-Dec;4(6):486-93. doi: 10.1370/afm.600. PMID: 17148625; PMCID: PMC1687172.
- Hopstaken RM, Stobberingh EE, Knottnerus JA, Muris JW, Nelemans P, Rinkens PE, Dinant GJ. Clinical items not helpful in differentiating viral from bacterial lower respiratory tract infections in general practice. J Clin Epidemiol. 2005 Feb;58(2):175-83. doi: 10.1016/j.jclinepi.2004.08.004. PMID: 15680752.
- Macfarlane J, Holmes W, Gard P, Macfarlane R, Rose D, Weston V, Leinonen M, Saikku P, Myint S. Prospective study of the incidence, aetiology and outcome of adult lower respiratory tract illness in the community. Thorax. 2001 Feb;56(2):109-14. doi: 10.1136/thorax.56.2.109. PMID: 11209098; PMCID: PMC1746009.
- https://www.cdc.gov/patientsafety/features/be-antibiotics-aware.html Accessed September 19, 2023
- https://www.who.int/news-room/fact-sheets/detail/antibiotic-resistance Accessed September 19, 2023
- Caldas JP, Marba ST, Blotta MH, Calil R, Morais SS, Oliveira RT. Accuracy of white blood cell count, C-reactive protein, interleukin-6 and tumor necrosis factor alpha for diagnosing late neonatal sepsis. J Pediatr (Rio J). 2008 Nov-Dec;84(6):536-42. English, Portuguese. doi: 10.2223/JPED.1838. PMID: 19060982.
- Escadafal C, Incardona S, Fernandez-Carballo BL, Dittrich S. The good and the bad: using C reactive protein to distinguish bacterial from non-bacterial infection among febrile patients in low-resource settings. BMJ Glob Health. 2020 May;5(5):e002396. doi: 10.1136/bmjgh-2020-002396. PMID: 32467355; PMCID: PMC7259834.
- Wilson M. Fever in returned travelers. In: Keystone J, Kozarsky PE, Freedman DO, editors. Travel medicine. 2nd. Philadelphia, PA: Elsevier; 2008. pp. 513–521.
- Cooper EC, Ratnam I, Mohebbi M, Leder K. Laboratory features of common causes of fever in returned travelers. J Travel Med. 2014 Jul-Aug;21(4):235-9. doi: 10.1111/jtm.12122. Epub 2014 Apr 22. PMID: 24754384.
- Wilson M. Fever in returned travelers. In: Keystone J, Kozarsky PE, Freedman DO, editors. Travel medicine. 2nd. Philadelphia, PA: Elsevier; 2008. pp. 513–521
- Nishimura J, Dharap P, Raimbault S. The utility of basic blood counts, WBC histogram and C-reactive protein in detecting malaria. BMC Infect Dis. 2021 Sep 26;21(1):1006. doi: 10.1186/s12879-021-06704-5. PMID: 34565334; PMCID: PMC8474782.
- Zhang J, Zhou L, Yang Y, Peng W, Wang W, Chen X. Therapeutic and triage strategies for 2019 novel coronavirus disease in fever clinics. Lancet Respir Med. 2020 Mar;8(3):e11-e12. doi: 10.1016/S2213-2600(20)30071-0. Epub 2020 Feb 13. PMID: 32061335; PMCID: PMC7159020.
- Wang L. C-reactive protein levels in the early stage of COVID-19. Med Mal Infect. 2020 Jun;50(4):332-334. doi: 10.1016/j.medmal.2020.03.007. Epub 2020 Mar 31. PMID: 32243911; PMCID: PMC7146693
- Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, Li B, Song X, Zhou X. Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. J Clin Virol. 2020 Jun;127:104370. doi: 10.1016/j.jcv.2020.104370. Epub 2020 Apr 14. PMID: 32344321; PMCID: PMC7194648.
- Malik P, Patel U, Mehta D, Patel N, Kelkar R, Akrmah M, Gabrilove JL, Sacks H. Biomarkers and outcomes of COVID-19 hospitalisations: systematic review and meta-analysis. BMJ Evid Based Med. 2021 Jun;26(3):107-108. doi: 10.1136/bmjebm-2020-111536. Epub 2020 Sep 15. PMID: 32934000; PMCID: PMC7493072
- Buyukbese Sarsu S, Sarac F. Diagnostic Value of White Blood Cell and C-Reactive Protein in Pediatric Appendicitis. Biomed Res Int. 2016;2016:6508619. doi: 10.1155/2016/6508619. Epub 2016 May 4. PMID: 27274988; PMCID: PMC4870336.
- Van Hemelrijck M, Holmberg L, Garmo H, Hammar N, Walldius G, Binda E, Lambe M, Jungner I. Association between levels of C-reactive protein and leukocytes and cancer: three repeated measurements in the Swedish AMORIS study. Cancer Epidemiol Biomarkers Prev. 2011 Mar;20(3):428-37. doi: 10.1158/1055-9965.EPI-10-1190. Epub 2011 Feb 4. PMID: 21297038; PMCID: PMC3078551
- Bruserud Ø, Aarstad HH, Tvedt THA. Combined C-Reactive Protein and Novel Inflammatory Parameters as a Predictor in Cancer-What Can We Learn from the Hematological Experience? Cancers (Basel). 2020 Jul 19;12(7):1966. doi: 10.3390/cancers12071966. PMID: 32707721; PMCID: PMC7409204
- Castro C, Gourley M. Diagnostic testing and interpretation of tests for autoimmunity. J Allergy Clin Immunol. 2010 Feb;125(2 Suppl 2):S238-47. doi: 10.1016/j.jaci.2009.09.041. Epub 2010 Jan 12. PMID: 20061009; PMCID: PMC2832720.